- Jakie właściwości fizyczne i mechaniczne charakteryzują nowy system hydrożelowy przeznaczony do minimalnie inwazyjnego wstrzykiwania
- W jaki sposób nano-hydroksyapatyt wpływa na strukturę hydrożelu i proliferację komórek kostnych
- Jak przebiega kontrolowane uwalnianie hydrofobowej simwastatyny z hydrożelu przez 35 dni
- Dlaczego system skutecznie hamuje osteoklastogenezę, ale nie promuje osteogenezy przy obecnych stężeniach leku
- Jakie wyzwania związane z dawkowaniem statyn należy rozwiązać przed zastosowaniem klinicznym
Czy hydrożele mogą zastąpić inwazyjne implanty w regeneracji kości?
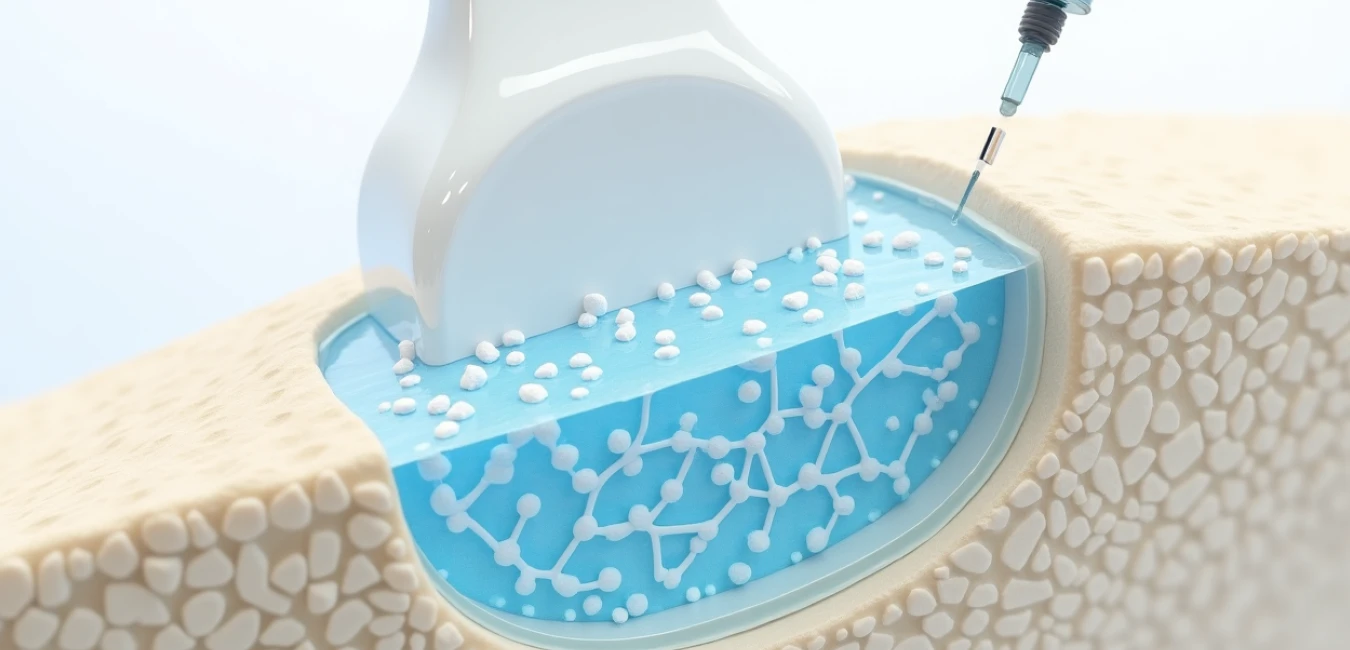
Tradycyjne biomaterialy implantowalne stosowane w regeneracji kostnej często wymagają inwazyjnych procedur chirurgicznych i nie zawsze dobrze wypełniają nieregularne ubytki kostne, co ogranicza ich skuteczność kliniczną. Szczególne wyzwanie stanowią osteoporotyczne zmiany w kręgach, gdzie dostęp chirurgiczny jest utrudniony, a kształt ubytku nieregularny. Te ograniczenia skłaniają naukowców do poszukiwania minimalnie inwazyjnych alternatyw, które mogłyby wypełniać złożone geometrie bez konieczności rozległych nacięć.
Hydrożele – trójwymiarowe sieci polimerowe bogate w wodę – zyskują na znaczeniu dzięki możliwości dostosowania właściwości, kontrolowanego uwalniania leków i zdolności do naśladowania natywnej macierzy pozakomórkowej. Szczególnie obiecujące są hydrożele termoreaktywacyjne, które przechodzą z płynnego stanu w żel pod wpływem temperatury ciała, co eliminuje potrzebę stosowania chemicznych czynników sieciujących i umożliwia precyzyjną aplikację przez cienkie igły.
Zespół naukowców z RCSI University of Medicine and Health Sciences w Dublinie opracował nowatorski system oparty na metylocelulozie (MC), kolagenie typu I i nano-hydroksyapatycie (nHAp). Metyloceluloza – biodegradowalny pochodny celulozy – wykazuje przejście sol-żel w podwyższonych temperaturach (~70°C), ale po dodaniu soli β-glicerofosforan (β-GP) temperatura żelowania obniża się do poziomu fizjologicznego. Dodanie kolagenu typu I dostarcza miejsca wiązania komórek (motyw GFOGER), podczas gdy hydroksyapatyt – główny składnik mineralny kości – zwiększa właściwości osteogenne i wytrzymałość mechaniczną. Celem badania było stworzenie platformy do kontrolowanego uwalniania simwastatyny (SVT) – hydrofobowego leku, który według wcześniejszych badań może jednocześnie promować tworzenie kości i hamować jej resorpcję.
Jak naukowcy projektowali i testowali hydrożel?
Badacze przygotowali serie formulacji hydrożeli, systematycznie modyfikując zawartość kolagenu (0–0,4% w/w) oraz rodzaj i stężenie hydroksyapatytu (mikro-HAp i nano-HAp w stężeniach 100% i 200% w stosunku do masy kolagenu). Kolagen bydlęcy typu I mieszano w 0,5 M kwasie octowym, a następnie łączono z 5% dyspersją metylocelulozy. Gotowe formulacje liofilizowano, sterylizowano tlenkiem etylenu i rehydratowano roztworem β-glicerofosforan (5,6% w/v, pH 7).
Właściwości reologiczne oceniano za pomocą reometru Discovery HR1 (TA Instruments), mierząc temperaturę przejścia sol-żel, moduł elastyczności i lepkość ścinającą. Strukturę mikroskopową analizowano metodą skaningowej mikroskopii elektronowej (SEM), a zdolność do wstrzykiwania testowano przez pomiar siły ekstruzji przez igły 16G i 26G przy użyciu testera mechanicznego Zwick/Roell.
Simwastatynę ładowano do hydrożeli w stężeniach 0,1–1 mg/g (z roztworu 20 mg/ml w 70% etanolu) i umieszczano na wkładkach z membraną PET w studzienkach zawierających PBS. Uwalnianie SVT monitorowano przez 35 dni metodą spektrofotometrii UV przy 239 nm. Stabilność hydrożelu oceniano przez pomiar masy w czasie (do 28 dni) w PBS w 37°C.
Wpływ biologiczny testowano na hodowlach preosteoblastów MC3T3-E1 (ocena osteogenezy: aktywność fosfatazy alkalicznej ALP, zawartość wapnia) oraz preosteoklastów RAW 264.7 (ocena osteoklastogenezy: aktywność kwaśnej fosfatazy opornej na winian – TRAP). Hydrożele zawieszano nad hodowlami różnicującymi, a aktywność metaboliczną mierzono testem AlamarBlue.
- Lepkość ścinająca: 1,81 Pa·s przy 100 s⁻¹
- Temperatura przejścia sol-żel: 27,2°C
- Moduł elastyczny po żelowaniu: 345,6 Pa
- Siła ekstruzji przez cienką igłę: 45,4 N
- Stabilność w PBS: do 28 dni
Jak kolagen i hydroksyapatyt zmieniają właściwości hydrożelu?
Wszystkie formulacje wykazały profil żelowania termicznego w zakresie 28,3–31,8°C oraz właściwości rozrzedzania ścinającego (shear-thinning), co czyni je odpowiednimi do wstrzykiwania. Zwiększenie zawartości kolagenu od 0% do 0,4% w/w znacząco podnosiło lepkość przy niskich szybkościach ścinania i zwiększało moduł elastyczny po żelowaniu – z 29,7 ± 4,6 Pa (sama MC) do 517,8 ± 46,6 Pa (MC + 0,4% kolagen). Mikroskopia SEM ujawniła, że włókna kolagenowe ściśle wiążą się z arkuszami metylocelulozy, zwiększając fizyczne interakcje w sieci polimerowej.
Dodanie hydroksyapatytu (nano lub mikro) nie zmieniło istotnie temperatury żelowania (27,2–30,2°C), ale zwiększyło lepkość przy niskich szybkościach ścinania, szczególnie w przypadku formulacji 100% i 200% mHAp oraz 100% nHAp. Paradoksalnie, obecność HAp obniżyła moduł elastyczny po żelowaniu (305,3 ± 82,5 Pa dla 100% mHAp, 259,3 ± 57,7 Pa dla 200% nHAp), prawdopodobnie przez dysocjację włókien kolagenowych od metylocelulozy – widoczną w obrazach SEM jako włókna kolagenowe unoszące się w porach zamiast przylegać do arkuszy MC.
Analiza FTIR potwierdziła tę zmianę: próbki zawierające HAp wykazywały intensywniejsze piki dla amid I i II (charakterystyczne dla kolagenu), podczas gdy hydrożele bez HAp nie pokazywały tych sygnałów. Sugeruje to, że HAp może zakłócać interakcje kolagen-MC, choć mechanizm pozostaje niejasny. Pomimo spadku sztywności, zdolność do wstrzykiwania nie uległa pogorszeniu – wszystkie formulacje można było wytłoczyć siłą poniżej średniej siły chwytu ludzkiego palca.
Test stabilności w PBS wykazał, że większość formulacji zachowuje integralność przez 28 dni, z wyjątkiem 200% nHAp, która wykazała wyraźną destabilizację od dnia 1 (retencja masy 97,6 ± 11,1% w dniu 2, tylko 23,1 ± 14,0% w dniu 21). To sugeruje, że wysokie stężenie nanocząstek może negatywnie wpływać na długoterminową stabilność żelu, prawdopodobnie przez zwiększoną dysocjację włókien kolagenowych lub zakłócenie hydrofobowych interakcji MC.
Czy hydrożel wspiera wzrost komórek kostnych?
Ocena biokompatybilności na preosteoblastach MC3T3 wykazała, że włączenie HAp znacząco zwiększyło proliferację komórek począwszy od dnia 3, z istotnymi różnicami w dniach 7 i 14 w porównaniu z kontrolą. Chociaż nie zaobserwowano istotnych różnic między mHAp i nHAp, formulacja 100% nHAp wykazała najwyższą proliferację i została wybrana do dalszych badań z simwastatyną.
Mechanizm tego efektu nie jest do końca jasny, ale może wiązać się ze zmienioną organizacją włókien kolagenowych, która dostarcza dodatkowych miejsc wiązania komórek, lub z bezpośrednim wpływem HAp i jego produktów rozpadu na zachowanie komórek. Liczne badania potwierdzają rolę HAp w poprawie biokompatybilności biomateriałów i promowaniu proliferacji komórek, szczególnie w systemach hydrożelowych.
- Stabilność porównywalną z formulacjami bez HAp
- Najwyższą obserwowaną proliferację preosteoblastów
- Zachowanie właściwości termoreaktywacyjnych i wstrzykiwalności
Jak simwastatyna uwalnia się z hydrożelu?
Simwastatyna – hydrofobowy lek z grupy statyn – stanowi wyzwanie dla systemów opartych na hydrożelach ze względu na wysoką zawartość wody. Badacze testowali różne stężenia ładowania SVT (0,1–1 mg/g hydrożelu) w formulacji 100% nHAp. Wyniki wykazały, że tylko najwyższe stężenie ładowania (1 mg/g) zapewniało przedłużone uwalnianie przez 5 tygodni.
Profil uwalniania SVT z hydrożelu 100% nHAp (1 mg/g) charakteryzował się typowym wzorcem pierwszego rzędu: wczesne gwałtowne uwalnianie (burst release), a następnie stopniowe spowolnienie prowadzące do plateau. W kolejnych dniach hydrożel uwalniał: 34,4 µg (dzień 1), 67,1 µg (dzień 3), 85,9 µg (dzień 5), 141,6 µg (dzień 7), osiągając łączne uwalnienie 296,3 µg do dnia 35. Co istotne, nie stwierdzono istotnych różnic w profilu uwalniania między formulacją z nHAp a formulacją bez HAp.
Przedłużone uwalnianie prawdopodobnie wynika z fizycznej natury sieciowania łańcuchów celulozy, nadanej przez stopień metylacji. Mechanizm termogelacji polega na temperaturowo zależnej reorganizacji sieci polimerowych, która zwiększa hydrofobowe interakcje fizyczne. Te regiony hydrofobowe mogą działać jako rezerwuary, które ułatwiają adsorpcję SVT. Przy wyższych stężeniach ładowania (1 mg/g) może dochodzić do zmienionej reorganizacji hydrofobowych regionów MC podczas żelowania, co pozwala na większe pęcznienie hydrożelu i wolniejszą desorpcję leku, a następnie powolną dyfuzję wolnej SVT.
Ładowanie SVT miało wyraźny wpływ na właściwości fizyczne: znacząco zwiększyło temperaturę przejścia sol-żel i obniżyło końcową sztywność po żelowaniu. Mimo tych zmian, przejście fazowe nadal następowało między temperaturą pokojową a temperaturą ciała, co zachowuje właściwości potrzebne do minimalnie inwazyjnego podania. Test stabilności wykazał, że włączenie SVT nie wpływa istotnie na degradację ani w formulacji bez HAp, ani z 100% nHAp.
Czy uwalniająca się simwastatyna promuje tworzenie kości?
Aby ocenić wpływ uwalnianej SVT na osteogenezę, hydrożele zawierające 1 mg/g SVT (formulacje z kolagenem i nHAp) zawieszono nad różnicującymi się hodowlami preosteoblastów MC3T3. Wyniki były nieoczekiwane i kontrastowały z wcześniejszymi doniesieniami o osteogennym działaniu simwastatyny.
Aktywność metaboliczna komórek została utrzymana po początkowych 7 dniach ekspozycji na uwalniającą się SVT, choć grupy eksponowane na formulacje zawierające SVT (kolagen + SVT i nHAp + SVT) wykazywały niższą aktywność metaboliczną. Ten deficyt wyrównał się w dniu 21, a w dniu 28 wszystkie grupy wykazywały porównywalną aktywność, z wyjątkiem kolagen-SVT, która pozostała nieznacznie niższa.
Pomiar fosfatazy alkalicznej (ALP) w dniu 14 – wczesnego markera osteogenezy – ujawnił wyraźne osłabienie produkcji ALP w grupach hydrożelowych w porównaniu z kontrolą. Co więcej, włączenie SVT dodatkowo hamowało produkcję ALP, z istotnymi spadkami zarówno w grupie kolagen + SVT, jak i nHAp + SVT w porównaniu z hydrożelami bez SVT. Krytycznie, nie wykryto żadnej produkcji wapnia w żadnej z grup hydrożelowych, z SVT lub bez, przez cały 28-dniowy okres hodowli osteogennej.
Te wyniki kontrastują z licznymi wcześniejszymi badaniami wykazującymi osteogenną aktywność SVT in vitro na różnych komórkach macierzystych i preosteoblastach. Prawdopodobnym wyjaśnieniem jest problem z dawkowaniem SVT. Chociaż ładowanie 1 mg/g było wykonalne i zapewniało długoterminowe uwalnianie, wczesne gwałtowne uwalnianie mogło prowadzić do przedawkowania w małych objętościach mediów hodowlanych używanych w eksperymentach komórkowych.
„Nasze wyniki pokazują, że podczas gdy przedłużone uwalnianie SVT zostało osiągnięte, system nie promował jednocześnie tworzenia kości przy testowanych warunkach dawkowania” – konkludują autorzy badania. Wskazują na potrzebę optymalizacji stężenia ładowania SVT i profilu wczesnego uwalniania, aby osiągnąć właściwą odpowiedź osteogenną.
Czy simwastatyna hamuje niszczenie kości przez osteoklasty?
W przeciwieństwie do rozczarowujących wyników osteogennych, badanie wpływu uwalnianej SVT na osteoklastogenezę przyniosło obiecujące rezultaty. Hodowle preosteoklastów RAW 264.7 stymulowano do różnicowania czynnikiem RANK-L (20 ng/ml) w obecności hydrożeli uwalniających SVT.
Hodowle wykazały wyższą wrażliwość na uwalnianie SVT niż preosteoblasty. Obserwowano utratę aktywności metabolicznej i śmierć komórek po 3 dniach ekspozycji na świeżo zawieszone hydrożele z SVT, prawdopodobnie z powodu gwałtownego wczesnego uwalniania (burst release). Aby ominąć ten problem, naukowcy przeprowadzili kolejny eksperyment, w którym najpierw inkubowali hydrożele przez 3 dni (pozwalając na burst release), a następnie przenieśli je do świeżej hodowli preosteoklastów.
To zmodyfikowane podejście pozwoliło na utrzymanie żywotnych preosteoklastów przez 7 dni. Co kluczowe, ocena różnicowania osteoklastycznego wykazała całkowity brak aktywności TRAP (kwaśnej fosfatazy opornej na winian – markera dojrzałych osteoklastów) w hodowlach eksponowanych na uwalniającą się SVT. To sugeruje, że SVT skutecznie przerwała tworzenie osteoklastów lub zakłóciła ich funkcję resorpcji kości.
Te wyniki są w dużej mierze zgodne z literaturą opisującą mechanizmy antyosteoklastogenne simwastatyny, w tym zakłócanie sygnalizacji RANK-L i zmniejszoną produkcję reaktywnych form tlenu. Badanie potwierdza zatem potencjał terapeutyczny kontrolowanego uwalniania SVT w hamowaniu nadmiernej resorpcji kostnej, co jest szczególnie istotne w kontekście osteoporozy.
Jakie są ograniczenia badania i przyszłe kierunki?
Autorzy otwarcie przyznają kilka istotnych ograniczeń swojego badania. Przede wszystkim, uproszczone modele hodowli in vitro nie odzwierciedlają złożonego i dynamicznego środowiska in vivo. Profile uwalniania i efekty komórkowe obserwowane w warunkach laboratoryjnych mogą nie przekładać się bezpośrednio na kontekst kliniczny.
Krytycznym brakiem jest brak ko-hodowli osteoblastów i osteoklastów, co uniemożliwiło ocenę wzajemnej komunikacji między tymi typami komórek – fundamentalnego aspektu przebudowy kostnej. Ta interakcja międzykomórkowa może znacząco wpływać na aktywność SVT wobec zarówno tworzenia, jak i resorpcji kości, potencjalnie prowadząc do wyników odmiennych od tych obserwowanych w izolowanych hodowlach.
Ponadto, badanie nie obejmowało oceny farmakokinetycznej i farmakodynamicznej in vivo, co jest konieczne do zrozumienia, jak optymalizować dawkowanie SVT dla osiągnięcia jednoczesnej stymulacji osteogenezy i hamowania osteoklastogenezy. Dane wskazują na konieczność:
• Obniżenia stężenia ładowania SVT lub modyfikacji profilu wczesnego uwalniania (burst release)
• Przeprowadzenia badań na modelach ko-hodowli osteoblastów i osteoklastów
• Walidacji in vivo w modelach zwierzęcych ubytków kostnych
• Oceny farmakokinetyki i bezpieczeństwa systemowego
„Pomimo tych ograniczeń, dane przedstawione w tym badaniu oferują cenne informacje o zachowaniu SVT w systemie hydrożelowym i wskazują kierunek dla potencjalnie skutecznego uwalniania leku oraz poprawy odpowiedzi komórkowych w uproszczonych modelach in vitro” – podkreślają autorzy.
Co to oznacza dla przyszłości regeneracji kostnej?
Opracowany system hydrożelowy MC/kolagen/nHAp demonstruje potencjał jako uniwersalna platforma do minimalnie inwazyjnego dostarczania hydrofobowych leków w regeneracji kostnej. Kluczowe właściwości – termoreaktywacyjność, wstrzykiwalność, stabilność przez 28 dni i kontrolowane uwalnianie – czynią go obiecującym kandydatem do zastosowań klinicznych, szczególnie w trudno dostępnych lokalizacjach anatomicznych, takich jak osteoporotyczne zmiany w kręgach. Udane hamowanie osteoklastogenezy przez uwalniającą się simwastatynę potwierdza wykonalność koncepcji lokalnej terapii antyresorpcyjnej. Jednak brak jednoczesnej stymulacji osteogenezy przy testowanych dawkach podkreśla wyzwania związane z osiągnięciem synergicznego efektu anabolicznego i antykatabolicznego przy użyciu pojedynczej substancji terapeutycznej. Platforma ta może znaleźć zastosowanie nie tylko dla simwastatyny, ale także dla innych hydrofobowych cząsteczek terapeutycznych w regeneracji kostnej, oferując znaczącą przewagę nad tradycyjnymi stałymi implantami dzięki zdolności do wypełniania złożonych geometrii defektów przy minimalnej inwazyjności chirurgicznej.
Pytania i odpowiedzi
❓ Jakie są główne zalety termoreaktywacyjnego hydrożelu w porównaniu z tradycyjnymi implantami kostnymi?
Hydrożel przechodzi z płynnego stanu w żel przy temperaturze ciała (27,2°C), co umożliwia wstrzykiwanie przez cienkie igły bez konieczności rozległych nacięć chirurgicznych. System wypełnia nieregularne ubytki kostne, zachowując stabilność przez 28 dni i kontrolowanie uwalniania leków. To szczególnie korzystne w trudno dostępnych lokalizacjach, takich jak osteoporotyczne zmiany w kręgach, gdzie tradycyjne implanty mają ograniczone zastosowanie.
❓ Dlaczego simwastatyna w hydrożelu hamuje osteoklasty, ale nie stymuluje osteoblastów?
Problem prawdopodobnie wynika z dawkowania. Wczesne gwałtowne uwalnianie SVT (burst release) mogło prowadzić do przedawkowania w małych objętościach mediów hodowlanych, co hamowało zarówno aktywność metaboliczną, jak i produkcję fosfatazy alkalicznej w preosteoblastach. Preosteoklasty okazały się jeszcze bardziej wrażliwe na burst release, co wymagało modyfikacji protokołu. Autorzy sugerują potrzebę obniżenia stężenia ładowania lub modyfikacji profilu uwalniania.
❓ Jak nano-hydroksyapatyt wpływa na właściwości mechaniczne hydrożelu?
Dodanie nano-HAp paradoksalnie obniża moduł elastyczny po żelowaniu (z 517,8 Pa dla samego kolagenu do 259,3 Pa dla 200% nHAp), prawdopodobnie przez dysocjację włókien kolagenowych od metylocelulozy. Jednocześnie nHAp zwiększa lepkość przy niskich szybkościach ścinania i znacząco poprawia proliferację preosteoblastów, przy czym formulacja 100% nHAp wykazała najwyższą proliferację komórek przy zachowaniu stabilności przez 28 dni.
❓ Jakie są główne ograniczenia badania, które należy rozwiązać przed zastosowaniem klinicznym?
Kluczowe ograniczenia to brak modeli ko-hodowli osteoblastów i osteoklastów, co uniemożliwiło ocenę wzajemnej komunikacji między komórkami w procesie przebudowy kostnej, oraz brak badań in vivo oceniających farmakokinetykę i bezpieczeństwo systemowe. Uproszczone modele in vitro nie odzwierciedlają złożonego środowiska klinicznego, dlatego niezbędna jest walidacja w modelach zwierzęcych przed translacją do zastosowań u ludzi.
❓ Czy system może być wykorzystany do dostarczania innych leków poza simwastatyną?
Tak, autorzy podkreślają potencjał platformy jako uniwersalnego nośnika hydrofobowych leków w regeneracji kostnej. Regiony hydrofobowe metylocelulozy mogą działać jako rezerwuary dla różnych hydrofobowych cząsteczek terapeutycznych, oferując kontrolowane uwalnianie przez kilka tygodni. To otwiera możliwości dla innych substancji anabolicznych lub antyresorpcyjnych, które mogłyby być dostosowane do specyficznych potrzeb klinicznych w leczeniu ubytków kostnych.